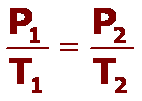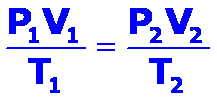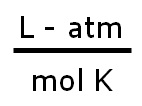ESTEQUIOMETRIA DE GASES
Problemas de Estequiometría de gases
La estequiometría trata del cálculo químico de cantidades de componentes que intervienen en una reacción química dados al menos la cantidad de uno de ellos.
La estequiometría de gases se aplica en aquéllos casos en ,los que interviene un gas o varios en la reacción, se dispondrá de datos volumínicos para determinar el volúmen de algún componente.
Hay tres tipos de problemas de Estequiometría de gases:
Moles-Volúmen (o Volúmen-Moles)
Peso-Volúmen (o volúmen-peso)
Volúmen-Volúmen
1. Estequiometría. Moles-Volúmen.
Si nos dan los moles de cada componente y se desea hallar el volúmen de cada uno en la muestra, nos deben de informar de temperatura y presión a la que tiene lugar el proceso.
Convertimos moles iniciales en moles finales usando los coeficientes de la reacción química ajustada
Convertimos moles finales a volúmen final usando la ecuación de la Ley de Gases Ideales.
Aquí ponemos un ejemplo para su mejor comprensión:
Dado el Proceso de Síntesis de Haber:
N2(g) + 3H2(g) -----> 2NH3(g)
¿Cuantos litros de NH3 pueden obtenerse a 27 ºC y a una presión de 760 torr, si se consumen 20 moles de N2?
Convertimos moles dados a moles finales:
Según la reacción ajustada:
1 mol N2 = 2 moles NH3
20 moles N2 * 2 moles NH3 / 1 mol N2 = 40 moles NH3 obtenidos
Convertimos moles finales a litros finales:
Usando la ecuación de la Ley de Gase Ideales PV = nRT y R=0.0821 litro-atm / mol-ºK, nos aseguraremos de convertir las temperaturas siempre a ºK y la presión a atm.
P = 760 torr * 1 atm / 760 torr = 1 atm
T = 27 + 273 = 300 K
Resolviendo la ecuación para V = nRT / P = (40 moles NH3) (0.0821 litro-atm / mol-ºK) (300 K) / 1 atm = 985.2 litros NH3
La estequiometría trata del cálculo químico de cantidades de componentes que intervienen en una reacción química dados al menos la cantidad de uno de ellos.
La estequiometría de gases se aplica en aquéllos casos en ,los que interviene un gas o varios en la reacción, se dispondrá de datos volumínicos para determinar el volúmen de algún componente.
Hay tres tipos de problemas de Estequiometría de gases:
Moles-Volúmen (o Volúmen-Moles)
Peso-Volúmen (o volúmen-peso)
Volúmen-Volúmen
1. Estequiometría. Moles-Volúmen.
Si nos dan los moles de cada componente y se desea hallar el volúmen de cada uno en la muestra, nos deben de informar de temperatura y presión a la que tiene lugar el proceso.
Convertimos moles iniciales en moles finales usando los coeficientes de la reacción química ajustada
Convertimos moles finales a volúmen final usando la ecuación de la Ley de Gases Ideales.
Aquí ponemos un ejemplo para su mejor comprensión:
Dado el Proceso de Síntesis de Haber:
N2(g) + 3H2(g) -----> 2NH3(g)
¿Cuantos litros de NH3 pueden obtenerse a 27 ºC y a una presión de 760 torr, si se consumen 20 moles de N2?
Convertimos moles dados a moles finales:
Según la reacción ajustada:
1 mol N2 = 2 moles NH3
20 moles N2 * 2 moles NH3 / 1 mol N2 = 40 moles NH3 obtenidos
Convertimos moles finales a litros finales:
Usando la ecuación de la Ley de Gase Ideales PV = nRT y R=0.0821 litro-atm / mol-ºK, nos aseguraremos de convertir las temperaturas siempre a ºK y la presión a atm.
P = 760 torr * 1 atm / 760 torr = 1 atm
T = 27 + 273 = 300 K
Resolviendo la ecuación para V = nRT / P = (40 moles NH3) (0.0821 litro-atm / mol-ºK) (300 K) / 1 atm = 985.2 litros NH3
Ver : video sobre estequiometria de gases http://www.youtube.com/watch?v=HUHz6dCdAm8
fuentes de internet: http://www.blogger.com/blogger.g?blogID=8959899795983988087#editor/target=post;postID=3502529502520496149
avataravatar diego





 BIENVENIDOS ESTUDIANTES A CONOCER ACERCA EL ESTADO GASEOSO, PROPIEDADES . ESTRUCTURAS Y SUS LEYES.
BIENVENIDOS ESTUDIANTES A CONOCER ACERCA EL ESTADO GASEOSO, PROPIEDADES . ESTRUCTURAS Y SUS LEYES.